REAKSI-REAKSI ALKANA, ALKENA, ALKUNA
- Reaksi dalam Alkana
Alkana merupakan keluarga hidrokarbon yang mengandung hanya ikatan tunggal antar atom-atom karbonnya.
Ikatan pada alkana berciri tunggal, kovalen dan nonpolar. Oleh karenanya alkana relatif stabil (tidak reaktif) terhadap kebanyakan asam, basa, pengoksidasi atau pereduksi yang dapat dengan mudah bereaksi dengan kelompok hidrokarbon lainnya. Karena sifatnya yang tidak reaktif tersebut, maka alkana dapat digunakan sebagai pelarut.
Walaupun alkana tergolong sebagai senyawaan yang stabil, namun pada kondisi dan pereaksi tertentu alkana dapat bereaksi dengan asam sulfat dan asam nitrat, sekalipun dalam temperatur kamar. Hal tersebut dimungkinkan karena senyawa kerosin dan gasoline mengandung banyak rantai cabang dan memiliki atom karbon tersier yang menjadi activator berlangsungnya reaksi tersebut. Berikut ini adalah beberapa reaksi alkana :
A. Oksidasi
Alkana sukar dioksidasi oleh oksidator lemah atau agak kuat seperti KMNO4, tetapi mudah dioksidasi oleh oksigen dari udara bila dibakar. Oksidasi yang cepat dengan oksigen yang akan mengeluarkan panas dan cahaya disebut pembakaran atau combustion.
Hasil oksidasi sempurna dari alkana adalah gas karbon dioksida dan sejumlah air. Sebelum terbentuknya produk akhir oksidasi berupa CO2 dan H2 O, terlebih dahulu terbentuk alkohol, aldehid dan karboksilat.
Alkana terbakar dalam keadaan oksigen berlebihan dan reaksi ini menghasilkan sejumlah kalor (eksoterm)
CH4 + 2O2 → CO2 + 2H2 + 212,8 kkal/mol
C4H10 + 2O2 → CO2 + H2O + 688,0 kkal/mol
Reaksi pembakaran ini merupakan dasar penggunaan hidrokarbon sebagai penghasil kalor (gas alam dan minyak pemanas) dan tenaga (bensin), jika oksigen tidak mencukupi untuk berlangsungnya reaksi yang sempurna, maka pembakaran tidak sempurna terjadi. Dalam hal ini, karbon pada hidrokarbon teroksidasi hanya sampai pada tingkat karbon monoksida atau bahkan hanya sampai karbon saja.
2CH4 + 3O2 → 2CO + 4H2O
CH4 + O2 → C + 2H2O
Penumpukan karbon monoksida pada knalpot dan karbon pada piston mesin kendaraan bermotor adalah contoh dampak dari pembakaran yang tidak sempurna. Reaksi pembakaran tak sempurna kadang-kadang dilakukan, misalnya dalam pembuatan carbon black, misalnya jelaga untuk pewarna pada tinta.
B. Halogenasi
Reaksi dari alkana dengan unsur-unsur halogen disebut reaksi halogenasi. Reaksi ini akan menghasilkan senyawa alkil halida, dimana atom hidrogen dari alkana akan disubstitusi oleh halogen sehingga reaksi ini bisa disebut reaksi substitusi.
Halogenasi biasanya menggunakan klor dan brom sehingga disebut juga klorinasi dan brominasi. Halongen lain, fluor bereaksi secara eksplosif dengan senyawa organik sedangkan iodium tak cukup reaktif untuk dapat bereaksi dengan alkana.
Laju pergantian atom H sebagai berikut H3 > H2 > H1. Kereaktifan halogen dalam mensubtitusi H yakni fluorin > klorin > brom > iodin.
Reaksi antara alkana dengan fluorin menimbulkan ledakan (eksplosif) bahkan pada suhu dingin dan ruang gelap.
Jika campuran alkana dan gas klor disimpan pada suhu rendah dalam keadaan gelap, reaksi tidak berlangsung. Jika campuran tersebut dalam kondisi suhu tinggi atau di bawah sinar UV, maka akan terjadi reaksi yang eksoterm. Reaksi kimia dengan bantuan cahaya disebut reaksi fitokimia.
Dalam reaksi klorinasi, satu atau lebih bahkan semua atom hidrogen diganti oleh atom halogen. Contoh reaksi halogen dan klorinasi secara umum digambarkan sebagai berikut:
Untuk menjelaskan keadaan ini, kita harus membicarakan mekanisme reaksinya. Gambaran yang rinci bagaimana ikatan dipecah dan dibuat menjadi reaktan dan berubah menjadi hasil reaksi.
Langkah pertama dalam halogenasi adalah terbelahnya molekul halogen menjadi dua partikel netral yang dinamakan radikal bebas atau radikal. Suatu radikal adalah sebuah atom atau kumpulan atom yang mengandung satu atau lebih elektron yang tidak mempunyai pasangan. Radikal klor adalah atom yang klor yang netral, berarti atom klor yang tidak mempunyai muatan positif atau negatif.
Pembelahan dari molekul Cl2 atau Br2 menjadi radikal memerlukan energi sebesar 58 Kcal/mol untuk Cl2 dan 46 kcal/mol untuk Br2. Energi yang didapat dari cahaya atau panas ini, diserap oleh halongen dan akan merupakan reaksi permulaan yang disebut langkah permulaan.
Tahap kedua langkah penggadaan dimana radikal klor bertumbukan dengan molekul metan, radikal ini akan memindahkan atom atom hidrongen (H ) kemudian menghasilkan H-Cl dan sebuah radikal baru, radikal metil ( CH3).
Langkah I dari siklus penggadaan
Radikal bebas metil sebaliknya dapat bertumbukan dengan molekul (Cl2) untuk membedakan atom khlor dalam langkah penggandaan lainnya.
Langkah 2 dari siklus penggadaan
Langka ketiga Reaksi Penggabungan Akhir. Reaksi rantai radikal bebas berjalan terus sampai semua reaktan terpakai atau sampai radikalnya dimusnahkan. Reaksi dimana radikal dimusnahkan disebut langkah akhir. Langkah akhir akan memutuskan rantai dengan jalan mengambil sebuah radikal setelah rantai putus. Siklus penggandaan akan berhenti dan tak berbentuk lagi reaksi.
Suatu cara untuk memusnahkan radikal adalah dengan menggabungkan dua buah radikal untuk membentuk non radikal yang stabil dengan reaksi yang disebut reaksi penggabungan (coupling reaction). Reaksi penggabungan dapat terjadi bila dua buah radikal bertumbukan
Radikal lainnya juga dapat bergabung untuk mengakhiri rangkaian reaksi tersebut. Misalnya CH3dapat bergabung dengan Cl menghasilkan CH3Cl
Suatu masalah dengan radikal bebas adalah terbentuknya hasil campuran. Contohnya ketika reaksi khlorinasi metana berlangsung, konsentrasi dari metana akan berkurang sedangkan klorometan bertambah. Sehingga ada kemungkinan besar bahwa radikal klor akan bertumbukkan dengan molekul klormetan, bukannya dengan molekul metan.
Jika halogen berlebihan, reaksi berlanjut dan memberikan hasil-hasil yang mengandung banyak halogen berupa diklorometana, trikloroetana dan tetraklorometana
Keadaan reaksi dan perbandingan antara klor dan metana dapat diatur untuk mendapatkan hasil yang diinginkan.
Pada alkana rantai panjang, hasil reaksinya menjadi semakin rumit karena campuran dari hasil reaksi berupa isomer-isomer semakin banyak. Misalnya pada klorinasi propana
Bila alkana lebih tinggi dihalogenasi, campuran hasil reaksi menjadi rumit, pemurnian atau pemisahan dari isomer-isomer sulit dilakukan. Dengan demikian halogenasi tidak bermanfaat lagi dalam sintesis alkil halida. Akan tetapi pada sikloalkana tak bersubtitusi dimana semua atom hidrogennya setara, hasil murni dapat diperoleh. Karena sifatnya yang berulang terus reaksi semacam ini disebut reaksi rantai radikal bebas.
C. Sulfonasi Alkana
Sulfonasi merupakan reaksi antara suatu senyawa dengan asam sulfat. Reaksi antara alkana dengan asam sulfat berasap (oleum) menghasilkan asam alkana sulfonat. dalam reaksi terjadi pergantian satu atom H oleh gugus –SO3H. Laju reaksi sulfonasi H3 > H2 > H1.
Contoh :
D. Nitrasi
Reaksi nitrasi analog dengan sulfonasi, berjalan dengan mudah jika terdapat karbon tertier, jika alkananya rantai lurus reaksinya sangat lambat.
E. Pirolisis (Cracking)
Proses pirolisis atau cracking adalah proses pemecahan alkana dengan jalan pemanasan pada temperatur tinggi, sekitar 10000 C tanpa oksigen, akan dihasilkan alkana dengan rantai karbon lebih pendek
Proses pirolisis dari metana secara industri dipergunakan dalam pembuatan karbon-black. Proses pirolisa juga dipergunakan untuk memperbaiki struktur bahan bakar minyak, yaitu, berfungsi untuk menaikkan bilangan oktannya dan mendapatkan senyawa alkena yang dipergunakan sebagai pembuatan plastik. Cracking biasanya dilakukan pada tekanan tinggi dengan penambahan suatu katalis (tanah liat aluminium silikat).
2. Reaksi dalam Alkena
Sifat khas dari alkena adalah terdapatnya ikatan rangkap dua antara dua buah atom karbon. Ikatan rangkap dua ini merupakan gugus fungsional dari alkena sehingga menentukan adanya reaksi-reaksi yang khusus bagi alkena, yaitu adisi, polimerisasi dan pembakaran.
A. Adisi
Alkena dapat mengalami adisi Adisi adalah pengubahan ikatan rangkap (tak jenuh) menjadi ikatan tunggal (jenuh) dengan cara menangkap atom/gugus lain.
Pada adisi alkena 2 atom/gugus atom ditambahkan pada ikatan rangkap C=C sehingga diperoleh ikatan tunggal C-C. Beberapa contoh reaksi adisi pada alkena:
· Halogenasi
Halogenasi adalah adisi alkena dengan unsur halogen, X2 membentuk Halo alkana, RXn.
Contoh :
· Hidrogenasi
Reaksi adisi alkena dengan hidrogen sering dikenal sebagai hidrogenasi. Reaksi ini akan menghasilkan alkana.
Contoh :
CH2 = CH2 + H2 → CH3 – CH3
CH2=CH-CH3 + H2 → CH3CH2CH3
· Hidrohalogenasi
Hidrohalogenasi adalah reaksi alkena dengan hidrogen halida. Hasil reaksi antara alkena dengan hidrogen halida dipengaruhi oleh struktur alkena, apakah alkena simetris atau alkena asimetris.
1. Alkena simetris : akan menghasilkan satu haloalkana.
CH2 = CH2 + HBr → CH3 – CH2Br
2. Alkena asimetris akan menghasilkan dua haloalkana.
Produk utana reaksi dapat diramalkan menggunakan aturan Markonikov, yaitu: Jika suatu HX bereaksi dengan ikatan rangkap asimetris, maka produk utama reaksi adalah molekul dengan atom H yang ditambahkan ke atom C dalam ikatan rangkap yang terikat dengan lebih banyak atom H.
B. Polimerasi
Polimerisasi adalah penggabungan molekul-molekul sejenis menjadi molekul-molekul raksasa sehingga rantai karbon sangat panjang. Molekul yang bergabung disebut monomer, sedangkan molekul raksasa yang terbentuk disebut polimer.
Polimerisasi alkena terjadi berdasarkan reaksi adisi. Prosesnya mula-mula ikatan rangkap terbuka, sehingga terbentuk gugus dengan dua elektron tak berpasangan. Elektron-elektron tak berpasangan tersebut kemudian membentuk ikatan antargugsus, sehingga membentuk rantai.
C. Pembakaran
Seperti halnya alkana, alkena suku rendah mudah terbakar. Jika dibakar di udara terbuka, alkena menghasilkan jelaga lebih banyak daripada alkana. Hal itu terjadi karena alkena mempunyai kadar karbon lebih tinggi daripada alkana, sehingga pembakarannya menuntut lebih banyak oksigen. Pembakaran sempurna alkena menghasilkan gas CO2 dan uap air.
CH2=CH2 + 2 O2 → 2CO2 + 2H2O
33. Reaksi dalam Alkuna
Adanya ikatan rangkap tiga yang dimiliki alkuna memungkinkan terjadinya reaksi adisi, polimerisasi, substitusi dan pembakaran.
A. Adisi
· Adisi Hidrogen Halida
Adisi hidrogen halida (HX) pada senyawa alkuna berlangsung sama dengan yang terjadi pada senyawa alkena.
Reaksi di atas mengikuti aturan markonikov, tetapi jika pada reaksi alkena dan alkuna ditambahkan peroksida maka akan berlaku aturan antimarkonikov. Perhatikan reaksi berikut:
· Adisi Hidrogen
· Halogenisasi
Halogenisasi adalah reaksi alkana dengan halogen. Bromin and klorin dapat mengadisi pada alkuna seperti yang terjadi pada alkena. Jika 1 mol halogen mengadisi pada 1 mol alkuna, maka akan dihasilkan dihaloalkena.
Contoh :
Perhatikan reaksi di atas, reaksi pada tahap 2 berlaku aturan markonikov
· Adisi Halogen Halida
Hidrogen halida (HX) dapat mengadisi pada ikatan rankap 3 senyawa alkuna seperti yang terjadi pada adisi pada ikatan rangkap 2 senyawa alkena, dengan produk awal adalah vinyl halida.
Jika HX mengadisi pada alkuna ujung, maka akan dihasilkan produk dengan orientasi mengikuti aturan Markovnikov.
Molekul HX kedua mengadisi dengan orientasi seperti yang pertama.
B. Polimerisasi
Polimerisasi alkuna terjadi berdasarkan reaksi adisi. Prosesnya mula-mula ikatan rangkap terbuka, sehingga terbentuk gugus dengan dua elektron tak berpasangan. Elektron-elektron tak berpasangan tersebut kemudian membentuk ikatan antargugsus, sehingga membentuk rantai. 

C. Substitusi
Substitusi alkuna Substitusi (pengantian) pada alkuna dilakukan dengan menggantikan satu atom H yang terikat pada C=C di ujung rantai dengan atom lain.
D. Pembakaran
Pembakaran alkuna Pembakaran alkuna (reaksi alkuna dengan oksigen) akan menghasilkan CO2 dan H2O.
2CH=CH + 5 O2 → 4CO2 + 2H2O







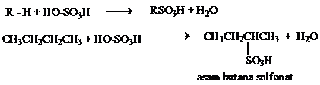









mantap
BalasHapusMantul sangat membantu untuk mendapatkan bintang dipelajaran kimia
BalasHapuskontol terimaksih
BalasHapusMantap jiwa, saya bisa mendapatkan bintang dengan mudah
BalasHapusTOP MARKOTOP
BalasHapusMantap sngt membantu
BalasHapus